Dr. Wiebke Salzmann
freie Lektorin und Autorin
Wissenstexte
Physik-Wissen
Magnetismus

Auf dieser Seite erwarten Sie diamagnetische Tomaten.
www.wissenstexte.de > Physik-Wissen > Elektromagnetismus > Magnetismus
Magnetismus
Auf der Seite Elektromotor wird die Funktionsweise eines Elektromagneten erläutert, die darauf beruht, dass elektrische Ströme von Magnetfeldern umgeben sind. Neben den Elektromagneten gibt es bekanntlich auch Permanentmagneten, also Magnete, die „von sich aus“ magnetisch sind, auch ohne dass ein elektrischer Strom fließt. Aber auch den in magnetischen Materialien (wie Eisen) von selbst auftretenden Magnetismus kann man letztlich auf elektrische Ströme zurückführen. Diese elektrischen Ströme beruhen auf Bewegungen der Elektronen im Atom. Elektronen haben einen Bahndrehimpuls und einen Eigendrehimpuls (Spin), beide sind mit einem magnetischen Moment verknüpft. (Vereinfacht kann man sich das so vorstellen, als ob das Elektron auf einer Bahn um den Atomkern herumwandert und sich zusätzlich um sich selbst dreht. Dieses Bild ist jedoch sehr stark vereinfacht, da Elektronen Quantenobjekte sind und sich als solche nicht auf klar definierten Bahnen bewegen. Der Aufenthaltsort eines Elektrons ist nicht durch eine solche Bahn gegeben, sondern durch eine räumliche Wahrscheinlichkeitsverteilung – als Orbital (s. u.) bezeichnet.) Ob und wie diese Bewegungen zu magnetischen Momenten führen können, hängt davon ab, wie die Elektronenkonfiguration eines Atoms ist.
Elektronenkonfiguration und Hundsche Regeln
Verschiedene chemische Elemente unterscheiden sich durch die Anzahl der Elektronen. Verschiedene Atome können sich auch noch in der Anzahl der Neutronen im Kern unterscheiden, aber alle Atome mit gleicher Elektronenzahl gehören zum selben chemisches Element. Das kommt daher, dass die chemischen Eigenschaften nur durch die Elektronenanzahl bestimmt wird. (Die Protonenanzahl ist immer gleich der Elektronenanzahl.)
Das leichteste Element ist der Wasserstoff, er hat ein Elektron. Das nächste ist Helium mit 2 Elektronen, usw.
Die Elektronen befinden sich in der Elektronenhülle um den Atomkern. Dort schwirren sie aber nicht beliebig herum, sondern folgen einer bestimmten Ordnung. Die Elektronenhülle ist zunächst in Schalen unterteilt. Diese werden von unten nach oben durchnummeriert, die Schale 1 ist also die niedrigste. Sie hat den geringsten Abstand zum Kern und auch die niedrigste Energie. Je höher die Nummer (sie heißt übrigens Hauptquantenzahl n), desto höher die Energie. Die Schalen sind in Unterschalen unterteilt, und zwar entspricht die Anzahl Unterschalen der Hauptquantenzahl n. Die 1. Schale hat also 1 Unterschale, die 2. hat 2 Unterschalen usw. Die Unterschalen werden mit der Nebenquantenzahl l bezeichnet. l kann die Werte 0, 1, … , n − 1 annehmen und hat mit der geometrischen Form der Orbitale zu tun. Statt der Zahlen verwendet man aber oft Buchstaben, für die Unterschale mit l = 0 das s, für l = 1 das p, l = 2 das d usw. Jede Unterschale wiederum ist in Orbitale unterteilt. Deren Anzahl beträgt 2l + 1. Eine s-Unterschale hat also 1 Orbital (l = 0), eine p-Unterschale hat 3 Orbitale. Die einzelnen Orbitale unterscheiden sich in einer weiteren Quantenzahl, der magnetischen Quantenzahl ml des Drehimpulses, die die räumliche Orientierung des Bahndrehimpulses des Elektrons bezeichnet. Jedes Orbital kann nun mit maximal 2 Elektronen besetzt werden. Keine zwei Elektronen eines Atoms dürfen in allen Quantenzahlen übereinstimmen, müssen sich also immer in mindestens einer Quantenzahl unterscheiden. Wir brauchen also noch eine weitere Quantenzahl für die beiden Elektronen in einem Orbital – das ist der Elektronenspin. Der Spin kann zwei Richtungen einnehmen, die den Werten ½ und −½ entsprechen. Befinden sich zwei Elektronen im selben Orbital, müssen ihre Spins also entgegengesetzt gerichtet sein.
- Abb. 1a ¦ Aufbau der Elektronenhülle
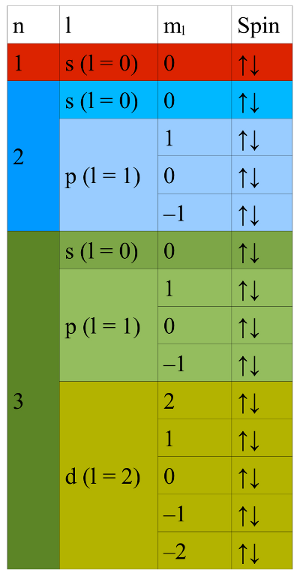
- Unterteilung der Elektronenhülle für die ersten 3 Schalen; jede Schale besteht aus n Unterschalen, jede Unterschale aus 2l + 1 Orbitalen, jedes Orbital kann maximal 2 Elektronen mit entgegengesetztem Spin aufnehmen.
Die Orbitale werden nun von unten nach oben aufgefüllt, wobei einige Regeln gelten.
Zum einen werden sie in der Reihenfolge zunehmender Energie besetzt. Zunächst entspricht das der Reihenfolge 1s, 2s, 2p, 3s, 3p. Da das 4s-Orbital eine geringere Energie hat als die 3d-Orbitale, wird also nach den 3p-Orbitalen erst das 4s-Orbital und danach erst die 3d-Orbitale besetzt. Für höhere Schalen gibt es ähnliche Verschiebungen.
Dann muss in jedem Fall das Pauli-Prinzip erfüllt sein, zwei Elektronen dürfen also nicht in allen Quantenzahlen übereinstimmen, sondern müssen sich in mindestens einer unterscheiden.
Als drittes gibt es noch die Hundschen Regeln. Danach werden die Orbitale einer Unterschale so besetzt, dass die Summe S der Spins maximal wird. Die drei 2p-Orbitale werden also erst nach und nach mit je einem Elektron besetzt, deren Spins alle parallel sind und sich also addieren. Erst das vierte muss in ein Orbital, in dem schon ein Elektron sitzt. Es muss seinen Spin dann wegen des Pauli-Prinzips antiparallel zu diesem einstellen. Dabei werden die Orbitale einer Unterschale so aufgefüllt, dass der Gesamtbahndrehimpuls L (der Betrag der Summe der ml-Werte) maximal wird.
- Abb. 1b ¦ Auffüllen der Elektronenhülle
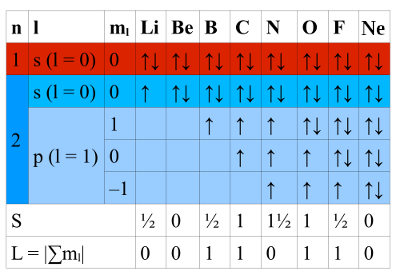
- Gezeigt sind die Elektronenkonfigurationen der Elemente Lithium (Li), Beryllium (Be), Bor (B), Kohlenstoff (C), Stickstoff (N), Sauerstoff (O), Fluor (F) und Neon (Ne).
Die Schalen werden von unten nach oben aufgefüllt, dabei ist bei der Besetzung der Orbitale die Bedingung zu erfüllen, dass die Summe S der Spins maximal wird. Zunächst werden also in jedes p-Orbital je ein Elektron gesetzt (bis einschließlich N), dann erst gibt es gepaarte Elektronen. Die Reihenfolge, in der die p-Orbitale besetzt werden, ergibt sich aus der Bedingung, dass der Gesamtbahndrehimpuls L ebenfalls betragsmäßig maximal werden muss, also die (betragsmäßige) Summe L der ml-Werte. Es wird also als erstes das p-Orbital mit ml = 1 besetzt, dann ml = 0, als letztes ml = −1.
Sowohl Spin als auch Bahndrehimpuls eines Elektrons erzeugen ein magnetisches Moment. Die magnetischen Eigenschaften – und um die geht es hier ja – hängen also davon ab, welchen Gesamtspin S, welchen Gesamtbahndrehimpuls L das Atom hat und welcher Gesamtdrehimpuls J sich aus beiden ergibt. Eine weitere Hundsche Regel sagt nun, dass L und S addiert (J = L + S) werden, wenn die Unterschale mehr als halbvoll ist. Ist sie weniger als halbvoll, gilt J = |L − S|.
- Abb. 1c ¦ Gesamtdrehimpuls
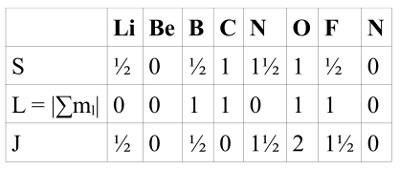
- Der Gesamtdrehimpuls J eines Atoms ergibt sich aus dem Gesamtspin S und dem Gesamtbahndrehimpuls L.
Vollständig gefüllte Unterschalen haben den Gesamtdrehimpuls 0 und tragen damit auch nicht zum magnetischen Moment eines Atoms bei. Bei den dargestellten Elementen ist das die 1s-Unterschale, sowie die 2s-Unterschale bei allen außer Lithium. Die 2p-Unterschale ist nur bei Ne vollständig gefüllt. Der Gesamtdrehimpuls wird ebenfalls 0, wenn eine Unterschale um ein Elektron weniger als halbgefüllt ist (C).
Atome mit vollständig gefüllten Schalen (die Edelgase) haben deshalb insgesamt einen Gesamtdrehimpuls 0 und haben daher kein magnetisches Moment.
Die Elektronenkonfiguration eines Atoms entscheidet also darüber, ob es ein magnetisches Moment hat oder nicht – Kohlenstoff hat kein magnetisches Moment, Sauerstoff hat eins.
Diamagnetismus
Die Bewegungen der Elektronen im Atom stellen elektrische Ströme dar. Bringt man ein Atom in ein äußeres Magnetfeld, werden im Atom zusätzlich Ströme „angeregt“, man sagt, die Ströme werden induziert. Diese induzierten Ströme sind so gerichtet, dass ihr Magnetfeld dem äußeren entgegengesetzt gerichtet ist. Es wird im Atom also ein magnetisches Moment induziert, das dem äußeren Magnetfeld entgegengerichtet ist. Dieses Phänomen bezeichnet man als diamagnetisch.
Dieser Vorgang spielt sich in allen Atomen ab. Hat ein Atom aber bereits ein „eigenes“ magnetisches Moment, ist das induzierte zu klein, um eine Rolle zu spielen. Hat das Atom jedoch kein magnetisches Moment, ist das induzierte magnetische Moment also das einzige, dann führt es dazu, dass das Atom aus dem anliegenden Magnetfeld herausgedrängt wird. (Weil es ja entgegengesetzt zum äußeren Feld magnetisiert ist.) Als diamagnetisch bezeichnet man Materialien i.d.R., wenn der Diamagnetismus der einzige im Material auftretende Magnetismus ist.
- Abb. 2 ¦ Ein diamagnetisches Atom im Magnetfeld
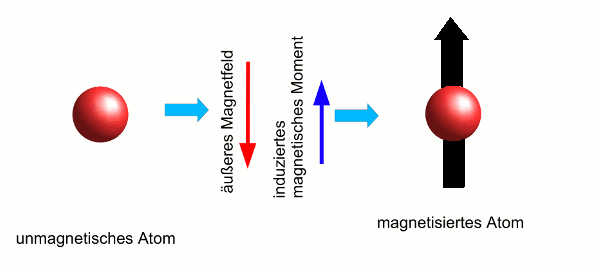
- Induktion eines magnetischen Moments in einem diamagnetischen Atom. Zunächst hat das Atom kein magnetisches Moment, die magnetischen Spin- und Bahnmomente aller Elektronen heben sich auf (links). Nun wird ein äußeres Magnetfeld angelegt (Mitte, roter Pfeil). Dieses induziert im Atom elektrische Ströme und damit ein magnetisches Moment (Mitte, blauer Pfeil), das dem äußeren Magnetfeld entgegengerichtet ist. Das Atom wird deshalb aus dem Feld herausgedrängt.
Nicht nur Atome haben magnetische Eigenschaften, für Moleküle gilt das genauso. Wasser ist ein diamagnetisches Material. Diamagneten werden wie gesagt aus einem äußeren Magnetfeld herausgedrängt. Das kann man in einem einfachen Experiment zeigen. Die Anregung zu diesem ExperimentParamagnetismus stammt aus dem Oktober-Heft 2009 von Spektrum der Wissenschaft, Hans-Joachim Schlichting: Magnetische Taschenspielertricks, Seiten 32–33. Dort wurde es mit Kirschen durchgeführt. Da diese jedoch im Oktober längst geerntet sind, habe ich Kirschtomaten genommen. Wichtig ist, dass die Früchte nicht zu schwer sind und dass sie genug Wasser enthalten. Zwei gleich große Früchte werden an den beiden Enden eines Holzstabes (Schaschlikstäbchen) so aufgehängt, dass der Stab, wenn er anschließend selbst aufgehängt wird, in Waage hängt. Dann nähert man sich einer der Tomaten mit einem Neodym-Magnet. (Zur Stärke dieses Magneten habe ich leider keine Angaben; es handelt sich um einen zylinderförmigen Neodym-Magnet von www.astromedia.de, 15 mm Durchmesser, 5 mm hoch; siehe Abbildung 6.) Da das diamagnetische Wasser aus dem Magnetfeld verdrängt wird, setzt sich die Tomate in Bewegung, weg vom Magneten.
- Abb. 3a ¦ Diamagnetische Tomaten

- Aufgehängte Tomaten werden von einem starken Magneten in Bewegung gesetzt. Hier halte ich den Magneten an die hintere (dunklere) Tomate. Diese bewegt sich vom Magneten weg, also nach links.
- Abb. 3b ¦ Die diamagnetischen Tomaten als Video
- Der Film hat ca. 15 MB.
Paramagnetismus
Genau genommen sind alle Atome diamagnetisch, aber beobachten kann man den Diamagnetismus nur, wenn er nicht durch Paramagnetismus oder Ferromagnetismus überlagert wird. Paramagnetisch sind Atome, die als Ganzes ein Magnet sind, bei denen sich die magnetischen Momente der Elektronen also nicht paarweise aufheben, sondern ein einzelnes Elektron übrig bleibt. Normalerweise merkt man nichts von dem magnetischen Moment der einzelnen Atome, weil die Wärmebewegung der Atome dafür sorgt, dass sich die Richtung jedes einzelnen magnetischen Momente ständig ändert und auch alle unterschiedliche Richtungen zeigen. Paramagnetisch sind beispielsweise Cu, Al oder Pt.
Erst wenn man ein paramagnetisches Material in ein äußeres Magnetfeld bringt, werden die magnetischen Momente der Atome ausgerichtet und das Materialstück wird zu einem Magneten. Dabei werden die magnetischen Momente parallel zum äußeren Magnetfeld ausgerichtet. Entfernt man das äußere Magnetfeld wieder, wird die Magnetisierung durch die Wärmebewegung sehr schnell wieder zerstört.
- Abb. 4 ¦ Ein paramagnetisches Material im Magnetfeld
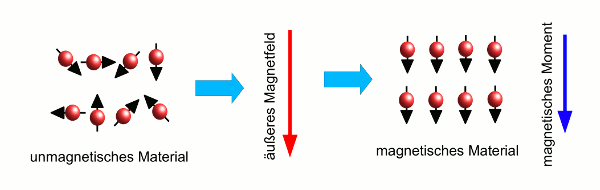
- Magnetisierung eines paramagnetischen Materials. Zunächst ist das Material nicht magnetisch, obwohl die Atome jedes für sich Magneten sind, da die Wärmebewegung für eine völlig ungeordnete Ausrichtung sorgt (links). Nun wird ein äußeres Magnetfeld angelegt (Mitte, roter Pfeil). Dieses richtet die magnetischen Momente der Atome parallel zum äußeren Feld aus, so dass das Material als Ganzes ein magnetisches Moment erhält (rechts, blauer Pfeil), das zum äußeren Magnetfeld parallel ist.
Der Wettstreit zwischen dem Magnetfeld, dass die Atome ausrichten will, und der Wärmebewegung führt dazu, dass der Paramagnetismus mit steigender Temperatur abnimmt.
Ferromagnetismus
In einigen Stoffen – neben dem bekanntesten Vertreter, dem Eisen, gehören auch Nickel und Cobalt dazu – wirkt zwischen den magnetischen Momenten der Atome eine Kraft, die die Wärmebewegung der Atome überwinden kann und die magnetischen Momente zueinander parallel ausrichtet. Nun ist ja aber bekanntlich nicht jedes Stück Eisen als Ganzes magnetisch. Das liegt daran, dass das Metall sich in einzelne Bezirke (die so genannten Weißschen Bezirke) aufteilt. Innerhalb eines einzelnen Weißschen Bezirks sind alle Atome gleich ausgerichtet, sodass jeder Bezirk eine Magnetisierung hat. Diese Magnetisierung zeigt aber in jedem Bezirk in eine andere Richtung, weshalb das Eisenstück als Ganzes unmagnetisch ist. Dabei springt die Magnetisierung nicht von einem Weißschen Bezirk zum nächsten, sondern es gibt zwischen den Bezirken Bereiche, in denen sich die Magnetisierung kontinuierlich von der Richtung des einen Bezirkes in die des Nachbarbezirkes ändert (dies sind die sogenannten Blochschen Wände). Bringt man das Eisen nun in ein äußeres Magnetfeld, werden die magnetischen Momente der Atome parallel zum Feld ausgerichtet – damit vergrößern sich die Weißschen Bezirke, deren Magnetisierung parallel zum äußeren Feld gerichtet sind, auf Kosten derjenigen mit falschen Magnetisierungsrichtungen, bis das Eisen als Ganzes magnetisch ist. Diese Magnetisierung bleibt erhalten, auch wenn man das Eisen aus dem äußeren Magnetfeld herausnimmt. Wie stabil die Magnetisierung ist, hängt von der Vorbehandlung des Eisens ab – so gibt es magnetisch hartes und magnetisch weiches Eisen.
Erhitzt man einen Ferromagneten über eine bestimmte Temperatur – die Curie-Temperatur –, verschwindet die permanente Magnetisierung und er wird paramagnetisch.
- Abb. 5 ¦ Ein ferromagnetisches Material im Magnetfeld
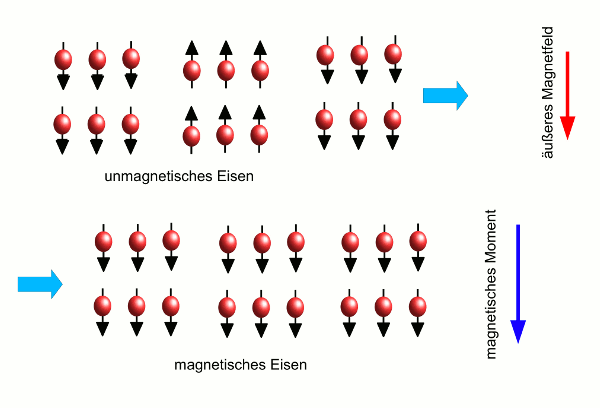
- Magnetisierung eines ferromagnetischen Materials. Zunächst ist das Material nicht magnetisch, obwohl die Atome jedes für sich Magneten sind, da das Material in Weißsche Bezirke aufgeteilt ist, von denen jeder eine andere Magnetisierung hat (links). Nun wird ein äußeres Magnetfeld angelegt (roter Pfeil). Dieses richtet die magnetischen Momente der Atome parallel zum äußeren Feld aus, so dass sich die Bezirke mit der richtigen Magnetisierung ausdehnen und die mit der falschen Ausrichtung verschwinden. So erhält das Material als Ganzes ein magnetisches Moment (rechts, blauer Pfeil), das zum äußeren Magnetfeld parallel ist.
- Abb. 6 ¦ Neodym-Magnete

- Aus Neodym-Eisen-Bor-Verbindungen lassen sich stärkste Magnete herstellen. Die abgebildeten Magnete haben einen Durchmesser von 15 mm und eine Höhe von jeweils 5 mm. Mir gelingt es nicht, einen der Magneten vom Stapel abzuheben. Zur Trennung muss ich sie seitlich verschieben und dann sehr schnell sein, bevor sie wieder zusammenschnappen (und aufpassen, dass keine Finger oder Haut mehr dazwischen ist …).
© Wiebke Salzmann, März 2010
