Dr. Wiebke Salzmann
freie Lektorin und Autorin
Wissenstexte
Physik-Wissen
Oberflächenspannung
Auf dieser Seite löst Netzwasser die Spannung …
www.wissenstexte.de > Physik-Wissen > Aufbau der Materie > Oberflächenspannung
Oberflächenspannung
– Oberflächenspannung und Kugelform von Tropfen
– hydrophob und hydrophil
– Kohäsion und Adhäsion
– Oberflächenspannung und Grenzflächenspannung
– Oberflächenspannung und Gravitation
– Kontaktwinkel und Benetzung
– Senken der Oberflächenspannung: Seife und Netzmittel
– Warum entsteht Schaum?
– Oberflächenspannung und Kapillarkräfte
Grenzflächen
Stoffe können in drei so genannten Phasen auftreten: fest, flüssig, gasförmig. In Flüssigkeiten und Festkörpern bestehen Bindungen zwischen den Atomen oder Molekülen und ihren Nachbarn. In einem Festkörper sind die Bindungen so starr, dass die Moleküle fest auf ihren Plätzen sitzen; in einer Flüssigkeit sind die Bindungen locker genug, dass die Teilchen umeinanderher wandern können. Die Flüssigkeit als Ganzes bleibt zusammen, kann aber ihre Form ändern, indem sie sich beispielsweise der Form eines Gefäßes oder eines Seebeckens anpasst. Zwischen den Molekülen oder Atomen eines Gases wirken (wenn die Dichte nicht zu hoch wird) überhaupt keine Kräfte.
Interessant ist jetzt, was passiert, wenn zwei Stoffe in unterschiedlichen Phasen aneinandergrenzen – welche Form nehmen die Grenzflächen zwischen beiden an? (Es geht hier nur um Fälle, bei denen keine chemischen Reaktionen zwischen beiden Stoffen auftreten.)
Setzt man zwei Festkörper nebeneinander, passiert gar nichts, beide bleiben, wie sie sind. Zwei Gase durchmischen sich im Laufe der Zeit vollständig. Stellt man einen Festkörper in ein Gas, passiert auch nichts weiter. Bleiben die Fälle, in denen Flüssigkeiten beteiligt sind.
Grenzflächen: Flüssigkeit in Gas
Kugelform von Wassertropfen
Im Innern einer Flüssigkeit werden die Moleküle von ihren Nachbarn angezogen, und zwar von allen Seiten gleich stark, da sie an allen Seiten mehr oder weniger gleich viele Nachbarn haben. An der Oberfläche grenzt die Flüssigkeit aber nun an ein Gas, nach außen haben die Oberflächenatome also keine Bindungen zu irgendwelchen Nachbarn. Es gibt nur Bindungen nach innen, weshalb in der Summe ein Zug nach innen herrscht. Das führt dazu, dass Flüssigkeiten ihre Oberfläche gegen das Gas möglichst klein halten wollen, um diesem Zug weitest gehend ausweichen zu können. Die kleinstmögliche Oberfläche ist die einer Kugel. Flüssigkeitstropfen sind daher immer kugelförmig (und haben nicht etwa die bekannte Tropfenform).
- Abb. 1 ¦ Tropfen in Luft
- Ein Tropfen blau gefärbten Wassers löst sich von einer Tülle. Er nimmt Kugelform an.
Dieses Bestreben von Flüssigkeiten, ihre Oberfläche klein zu halten, nennt man Oberflächenspannung. Dass das nicht nur ein Ausdruck ist, sondern dass eine Wasseroberfläche tatsächlich unter Spannung steht, sieht man, wenn man Wasserläufer beobachtet. Diese sind so leicht, dass die Oberflächenspannung des Wassers ausreicht, sie zu tragen.
- Abb. 2 ¦ Wasserläufer
- Um den Wasserläufer versinken zu lassen, müsste sich die Oberfläche verformen – sie ist an seinen Füßen ja auch leicht eingedellt. Jede Delle vergrößert aber die Wasseroberfläche, und das will das Wasser (oder seine Oberflächenspannung) auf jeden Fall verhindern. Bei schwereren Objekten reicht die Oberflächenspannung irgendwann nicht mehr, diese versinken.
- Abb. 2a ¦ Welle
- Wie gut die Oberflächenspannung eine Flüssigkeit zusammenhält, sieht man auch an dieser Welle, die schon sehr weit überhängt und noch nicht zerstäubt ist.
Das Gleiche gilt übrigens auch für das „Gegenstück“ zum Tropfen, der Luftblase im Wasser. Auch in der Blase nimmt die Oberfläche Kugelform an, um die Grenzfläche zwischen Luft und Wasser so klein wie möglich zu halten.
Flüssigkeit auf Festkörper
Wassertropfen auf Kohlblättern und Schwämmen
Sicher haben Sie schon einmal beobachtet, dass auf manchen Pflanzen die Regentropfen als Tropfen stehen bleiben und nicht verlaufen. Auch auf öligen Flächen zieht Wasser sich zu Tropfen zusammen, statt dass es zu einer größeren Lache verläuft (dieses Verlaufen nennt man „benetzen“). Das Wasser möchte auf fettigen Oberflächen oder den Blättern nicht nur gegenüber der Luft, sondern auch gegenüber dem jeweiligen Festkörper seine Oberfläche so klein wie möglich machen.
Hydrophob und Hydrophil
Öl und Wasser mischen sich nicht, das weiß jeder, der schon einmal Salatsaucen angerührt hat. Stoffe, die sich in Wasser lösen, nennt man hydrophil („wasserfreundlich“); solche, die sich nicht in Wasser lösen, heißen hydrophob („wassermeidend“). Auf Oberflächen aus hydrophilen Materialien verläuft Wasser (wie auf dem unbehandelten Holz in Abb. 3a); auf hydrophilen Oberflächen zieht es sich zu Tropfen zusammen (Abb. 3b). Es möchte zu hydrophilen Oberflächen also eine möglichst große Grenzfläche einnehmen, zu hydrophoben ein möglichst kleine.
- Abb. 3a ¦ Tropfen auf Holz
- Verspritzt man etwas Wasser auf diesen unbehandelten Holzbohlen, verteilt es sich zu einer Lache – Wasser benetzt das unbehandelte Holz.
- Abb. 3b ¦ Tropfen auf geöltem Holz
- Dieses Holz gehört zu einer frisch geölten Gartenbank. Die ölige Oberfläche stößt das Wasser ab, es zieht sich zu Tropfen zusammen und benetzt das geölte Holz nicht.
Auf hydrophilen Materialien ist es für das Wasser energetisch günstiger, möglichst viel mit diesem Material in Berührung zu kommen, also eine große Grenzfläche zu ihm zu schaffen. Deshalb läuft es auseinander. Damit wird zwar auch die Oberfläche zur Luft größer, aber es kommt für das Wasser auf die Gesamtbilanz an. Spart es auf der einen Seite mehr Energie ein, als es auf der anderen Seite verliert, ist die ausgedehnte Lache trotzdem günstiger.
Bei einer hydrophoben Unterlage dagegen spart das Wasser Energie, wenn es seine Grenzfläche zum hydrophoben Material möglichst klein hält und Tropfen bildet.
Die Flüssigkeit nimmt also immer die energetisch günstigste Oberfläche ein – also nicht unbedingt die flächenmäßig kleinste, sondern die mit der niedrigsten Energie. Und welche das ist, hängt von den angrenzenden Stoffen ab und ihrer Bindungsfreudigkeit gegenüber Wasser.
- Abb. 3c ¦ Grünkohl unter Wasser
- Die Abneigung des Wassers, die Kohlblätter zu benetzen, geht so weit, dass sich sogar stellenweise Luft auf den Blättern hält, wenn man sie unter Wasser taucht. Da man so von oben auf eine weitere Wasseroberfläche (oder auch Wasser„unter“fläche) blickt, entsteht der schimmernde Eindruck.
- Abb. 3d ¦ Zwetschen unter Wasser
- Noch stärker ist das Schimmern bei Zwetschen zu sehen. Wenn sie im Wasser liegen, werden sie ebenfalls nicht benetzt und sind von einer dünnen Luftschicht umgeben. Sie wirken regelrecht silbrig. Wasser hat einen höheren Brechungsindex als Luft. Wenn das Licht also vom Wasser in die dünne Luftschicht auf den Zwetschen eintritt, gerät es von einem optisch dichteren Medium in ein optisch dünneres und es kommt bei passenden Winkeln zur Totalreflexion, d. das Licht wird komplett reflektiert und dringt nicht in die Luftschicht und damit auch nicht bis zur Zwetsche vor. Man sieht dann nur die Wassergrenzfläche, aber nicht die Zwetsche dahinter. Deshalb das silbrige Schimmern. (Zur Totalreflexion siehe: Lichtleiter)
Kohäsion und Adhäsion
Die Kräfte, die eine Flüssigkeit zusammenhalten und zu einem Tropfen zusammenziehen möchten, nennt man Kohäsionskräfte. Kräfte zwischen der Flüssigkeit und einer festen Oberfläche nennt man Adhäsionskräfte (Haftkräfte). Je größer die Kohäsionskraft ist, desto eher bildet die Flüssigkeit Tropfen (desto größer ist also die Oberflächenspannung oder Grenzflächenspannung); je größer die Adhäsionskraft ist, desto stärker benetzt die Flüssigkeit den Festkörper. Überwiegt also die Kohäsion, bildet die Flüssigkeit Tropfen und benetzt den angrenzenden Festkörper nicht; überwiegt die Adhäsion, benetzt die Flüssigkeit ihn.
Grenzflächenspannung und Oberflächenspannung
Im Grunde meinen beide Begriffe dasselbe – nämlich das Bestreben einer Flüssigkeit, ihre Oberfläche klein zu halten. Die Oberflächenspannung ist ein bestimmter Fall der Grenzflächenspannung, nämlich das Angrenzen einer Flüssigkeit an ein Gas. Bei der Tropfenform von Wasser in Luft spricht man also von der Oberflächenspannung, bei der Tropfenform in oder auf Öl von der Grenzflächenspannung.
Oberflächenspannung und Gravitation
Stellt sich noch die Frage, warum (trotz der Oberflächenspannung) der Kaffee nicht kugelförmig in der Tasse steht.
Weil immer auch noch die Gravitation wirkt, die die Flüssigkeit in Richtung Erdmittelpunkt zieht. Die Flüssigkeit muss also den energetisch günstigsten Zustand finden zwischen Oberflächenspannung, die die energetisch günstigste Oberfläche erreichen will, und Gravitation, die möglichst viel Wasser an möglichst tiefer Stelle sammeln will (also den Zustand der niedrigsten potenziellen Energie erreichen will).
– Bei kleinen Wassermengen überwiegt die Oberflächenspannung und es bilden sich Tropfen.
– Bei großen Wassermengen gewinnt die Gravitation die Oberhand und das Wasser versucht, sich so nah wie möglich am Erdmittelpunkt aufzuhalten – da dem aber durch Gefäß oder Teich Grenzen gesetzt sind, werden diese natürlichen oder künstlichen Behälter von unten nach oben ausgefüllt.
Man sieht den Einfluss der Gravitation schon an diesem großen Tropfen auf dem Grünkohlblatt (Abb. 4). Er ist von seiner eigenen Schwerkraft plattgedrückt.
- Abb. 4 ¦ Tropfen auf Kohlblatt
Kontaktwinkel und Benetzung
Mit Kontaktwinkel ist der Winkel zwischen der Flüssigkeitsoberfläche und der Oberfläche des Festkörpers gemeint (Abb. 5).
Ein Tropfen, der einen Festkörper überhaupt nicht benetzt, ist ideal kugelförmig. Er berührt die feste Fläche also nur in einem Punkt und der Benetzungswinkel beträgt 180°. Tatsächlich kommt dieser Idealfall in der Natur nicht vor, ein Tropfen ist an seiner Unterseite immer mehr oder weniger abgeflacht und berührt den Festkörper mit einer größeren Fläche. Der Kontaktwinkel ist daher kleiner als 180°.
Das andere Extrem (das genauso wenig vorkommt) wäre ein Kontaktwinkel von 0°, also ein Tropfen, der sich völlig verläuft. In Realität bleibt der Wassertropfen auch nach der Benetzung mehr oder weniger zusammen und der Kontaktwinkel ist größer als 0°.
Die Grenze zwischen Benetzen und Nicht-benetzen ist ein Kontaktwinkel von 90°. Benetzende Flüssigkeiten bilden einen Kontaktwinkel von weniger als 90°, nicht benetzende einen von mehr als 90°.
- Abb. 5a ¦ Kontaktwinkel
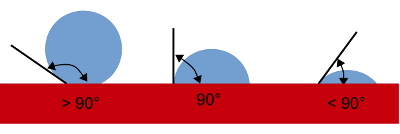
- Benetzende Flüssigkeiten haben einen Kontaktwinkel von weniger als 90° (rechts), nicht benetzende einen von mehr als 90° (links).
- Abb. 5b ¦ Kontaktwinkel
- Benetzende Flüssigkeiten haben einen Kontaktwinkel von weniger als 90°, wie bei dem Tropfen an dem Zweig (rechts), nicht benetzende einen von mehr als 90°, wie bei dem Tropfen auf dem Grünkohlblatt (links).
Netzwasser und Seife
Seife
Wasser hat eine recht hohe Oberflächenspannung, was mitunter stört. Wasser benetzt bspw. keine fettigen Flächen, also auch kein schmutziges Geschirr. Um das Fett vom Geschirr abwaschen zu können, muss es aber vom Wasser benetzt werden. Man braucht also einen Zusatz, der die Oberflächenspannung des Wassers herabsetzt und dafür sorgt, dass das Geschirr benetzt wird: Seife, in diesem speziellen Fall Spülmittel.
Dass die Oberflächenspannung herabgesetzt wird, liegt am Aufbau der Seifenmoleküle. Diese haben ein hydrophiles und ein hydrophobes Ende. Das hydrophobe Ende möchte dem Wasser ausweichen, weshalb sich an der Wasseroberfläche eine Schicht Spülmittel anlagert, deren hydrophobe Enden alle nach außen ragen. Das Spülmittel ist deshalb bestrebt, die Oberfläche zur Luft möglichst groß zu halten – die Kugelform kommt also nicht mehr in Frage, weshalb das Spülmittelwasser auch auf dem Schwamm sofort zerfließt (Abb. 6).
- Abb. 6 ¦ Oberflächenspannung und Spülmittel

- Auf einen trockenen Schwamm wurde etwas Wasser gegossen – dieses bleibt als Tropfen auf dem Schwamm liegen (links) und beginnt erst nach mehreren Stunden, allmählich einzusickern. Das mit etwas Spülmittel versetzte Wasser bildet gleich eine breitere Lache (Mitte) und versickert binnen weniger Sekunden (rechts).
Die Herabsetzung der Oberflächenspannung sorgt dafür, dass das Seifenwasser die zu reinigenden Objekte benetzt und überall hindringen kann, zum Beispiel auch in die Fasern von Textilien. Die eigentliche Reinigungswirkung kommt jedoch auch durch die Seifenmoleküle und ihre unterschiedlichen Enden zustande. Haben nicht alle Seifenmoleküle an der Wasseroberfläche Platz, müssen sie sich im Innern des Wassers aufhalten. Um trotzdem auch die hydrophoben Enden der Seifenmoleküle „zufrieden zu stellen“, bilden die Moleküle so genannte Micellen. Das heißt, die Seifenmoleküle lagern sich zu kugelförmigen Gebilden zusammen, in deren Inneres die hydrophoben Enden zeigen. In Berührung mit Wasser kommen so nur noch die nach außen ragenden hydrophilen Enden.
Stoffe, die sich nicht in Wasser lösen, lösen sich meist jedoch leicht in Öl und umgekehrt. So ist es auch bei den Seifenmolekülen – ihre hydrophoben Enden sind lipophil (fettliebend) und lösen den fettigen Schmutz sehr leicht. Die Seifenmoleküle bilden daher kugelförmige Hüllen um die Fettpartikel, die diese vollständig ummanteln und lösen den Schmutz so von der Oberfläche ab. (Es ist für den Fettschmutz energetisch günstiger, sich mit den hydrophoben Seifenenden zu umgeben, als an der verschmutzten Oberfläche haften zu bleiben.) Da die Außenseite der Schmutz-Ummantelung aber von hydrophilen Seifenenden gebildet wird, verteilen sich die umhüllten Fettpartikel im Wasser (das heißt, sie bilden eine Emulsion) und können weggespült werden.
- Abb. 7 ¦ Seifenlösung
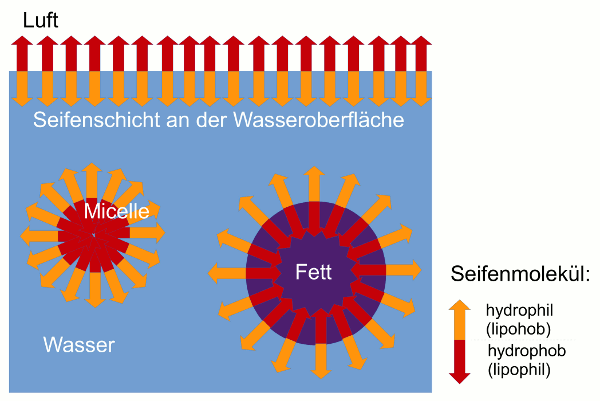
- Seifenmoleküle haben ein hydrophiles und ein hydrophobes Ende. Das hydrophobe Ende möchte möglichst nicht mit Wasser in Berührung kommen. Die Moleküle ordnen sich deshalb nur in bestimmter Weise an: 1. als Schicht an der Oberfläche, bei der das hydrophobe Ende in die Luft ragt; 2. als Micelle, bei der die hydrophoben Enden alle nach innen zeigen; 3. als Hülle um Fettpartikel, bei der die hydrophoben (und gleichzeitig lipophilen) Enden ins das Fetttröpfchen zeigen.
Netzwasser
Auch auf ausgetrockneter Erde bleibt Gießwasser erst einmal stehen. Beim Blumen gießen kann man ja auch in aller Ruhe warten, bis das Wasser endlich einsickert – gilt es dagegen, einen Brand in einem Moorboden oder einem Getreidesilo zu löschen, sollte es etwas schneller gehen, bis das Wasser eindringt. Dazu mischt man dem Löschwasser ein Mittel bei, das dafür sorgt, dass die Oberflächenspannung sinkt und das Wasser die Tropfenform aufgibt. Es steht dann nicht mehr auf der Erde, sondern breitet als Film aus und sickert praktisch sofort in den Boden ein. Mit anderen Worten: Es benetzt den Boden. Deshalb nennt man solche Mittel auch Netzmittel (der Begriff hat nichts mit „Netzen“ zu tun, sondern bezieht sich auf die Verbesserung der Benetzung) und das Wasser, dem Netzmittel zugesetzt wurde, heißt Netzwasser.
Lotuseffekt
Auch der bekannte Lotuseffekt hat mit der Oberflächenspannung des Wassers zu tun. Mit Lotuseffekt bezeichnet man die Selbstreinigungsfähigkeit mancher Oberflächen. Nach der Lotusblüte wurde diese Fähigkeit benannt, weil diese wegen genau dieses Effektes immer sauber ist. Selbstreinigende Oberflächen sind sehr hydrophob, der Kontaktwinkel entsprechend groß (bei Lotusblättern bis 170°). Dadurch haben aufliegende Wassertropfen beinah ideale Kugelform und können sehr leicht abperlen. Beim Abrollen nehmen die Tropfen dann Schmutzpartikel mit. Beim Lotuseffekt ist es also gerade die Nicht-Benetzbarkeit, die zur Reinigung führt.
Schaum
Seifenlösungen bilden Schaum – zwar braucht man den Schaum selbst eigentlich nicht zum Waschen, aber er zeigt an, dass Seife vorhanden ist und die Lösung sozusagen „waschfähig“ ist.
Im Innern einer Schaumblase ist Luft, die Wand besteht aus drei Schichten: Spülmittel, Wasser, Spülmittel. Vom Spülmittel ragen jeweils die hydrophoben Enden in die Luft (in den Außenraum bzw. nach innen in die Blase), die hydrophilen Enden in die Wasserschicht.
Dass Blasen trotzdem nicht ewig halten, ist wieder der Gravitation zu verdanken: Das Wasser fließt unter ihrem Einfluss nach unten, die Wasserschicht wird dünner und die Blase platzt schließlich.
Zum Abwaschen braucht man den Schaum selbst nicht, es reicht das Spülmittelwasser. Setzt man dem Löschwasser dagegen eine größere Menge Netzmittel (es heißt dann Schaummittel) zu, erzeugt man Löschschaum. Hier braucht man wirklich den Schaum – er kann eine Decke bilden und Feuer ersticken, er verhindert das Ausgasen bei brennbaren Flüssigkeiten (was brennt, sind in der Regel die Dämpfe, nicht die Flüssigkeit selbst), und haftet auch an senkrechten Wänden.
- Abb. 8 ¦ Schema einer Schaumblase
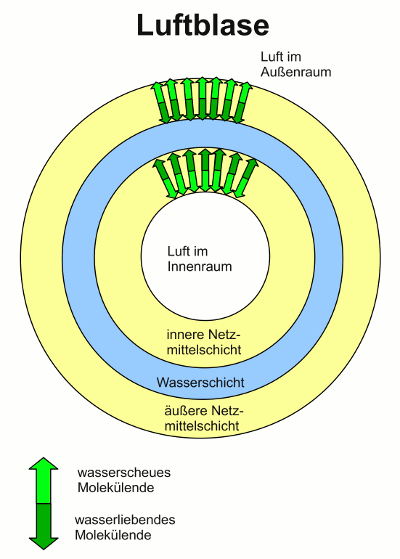
- Stellen Sie sich eine Luftblase vor, die rundherum von einer Schicht Wasser umgeben ist. Ohne Schaummittel hält so ein Gebilde nicht: Da Wasser seine Oberfläche möglichst klein machen will, fließt alles zusammen zu einer Kugel. Mit Schaummittel sieht es jedoch anders aus: Die Wasserblase hat zwei Oberflächen, eine innen und eine außen. An beiden Oberflächen liegt nun eine Schicht Schaummittel und bei beiden ragen die wasserscheuen Enden in den Luftraum (bei der inneren Schicht ins Innere der Blase, bei der äußeren Schicht in den Außenraum). Das Schaummittel hat wieder das Bestreben, die Oberfläche zur Luft so groß wie möglich zu machen, weshalb die Blase (und mit ihr der ganze Schaum) nun stabil bleibt.
Kapillarkräfte
In dünnen Röhrchen oder Poren („Kapillaren“) ist die Oberfläche im Vergleich zum Innenvolumen sehr groß. Der Einfluss der Oberflächen- oder Grenzflächenspannung kann also auch hier den der Gravitation übersteigen.
Für die Flüssigkeit ist es einerseits energetisch günstig, der Schwerkraft nachzugeben und nach unten zu fließen. Ist es eine benetzende Flüssigkeit, ist es andererseits aber auch günstig, eine möglichst große Grenzfläche mit der Kapillare zu haben. Es stellt sich der Zustand ein, der das Optimum unter beiden Einflüssen darstellt, also die niedrigstmögliche Energie hat.
Deshalb lassen Adhäsionskräfte die Flüssigkeit entgegen der Gravitation ein Stück an den Wänden nach oben steigen. Die Kohäsionskraft des Wassers hält die Flüssigkeit zusammen und zieht quasi die Wassersäule hinterher, sodass im Röhrchen eine Flüssigkeitssäule steht. Die Wassersäule „hängt“ an ihrer oberen Oberfläche und der Meniskus in der Kapillare ist konkav. Hier zeigt sich wieder der Kontaktwinkel von weniger als 90°.
Die Flüssigkeit steigt so weit, bis ein Gleichgewicht zwischen Adhäsionskraft und Schwerkraft erreicht ist. Das bedeutet, dass die Flüssigkeit in der Kapillare höher steht als im umgebenden Flüssigkeitskörper. Je enger der Radius der Kapillare ist, desto höher steigt die Flüssigkeit.
Eine nicht benetzende Flüssigkeit steigt die Flüssigkeit entsprechend nur auf eine geringere Höhe als der umgebende Flüssigkeitskörper sie aufweist, und hat einen konvexen Meniskus, was einem Kontaktwinkel von mehr als 90° entspricht.
- Abb. 9a ¦ Kapillaraufstieg
- Ein Stück Küchenpapier wird mit einem Ende in blau gefärbtes Wasser getaucht. Rasch steigt das Wasser in den Poren des Papiers auf, nach einer Minute ist das Papier völlig durchfeuchtet (weshalb es dann die Festigkeit verliert und umkippt).
- Abb. 9b ¦ Kapillaraufstieg
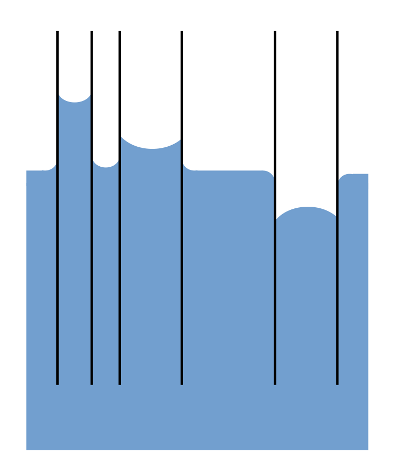
- Benetzt das Wasser die Kapillarwand (bspw. Glas), bildet sich ein konkaver Meniskus (nach innen gewölbt); benetzt es die Kapillarwand nicht (bspw. eingefettetes Glas), bildet sich ein konvexer (nach außen gewölbter) Meniskus.
Kapillarkräfte unterstützen Pflanzen dabei, Wasser aus dem Boden aufzunehmen. Die Verdunstung über die Blätter verursacht einen Sog, und an den Wurzeln erleichtern Kapillarkräfte für den Aufstieg in der Pflanze.
Mitunter verdanken die Pflanzen es auch den Kapillarkräften, dass sie überhaupt an Wasser herankommen: Auch das Grundwasser steigt oberhalb des eigentlichen Grundwasserkörpers in den Bodenporen ein Stück nach oben. Die Steighöhe ist je nach Bodenart sehr unterschiedlich – während in Ton mit seinen feinen Poren der kapillare Aufstieg im Meterbereich liegt, haben grobe Kiese so gut wie keinen Kapillarsaum.
Steckt man eine dünne Röhre in eine Flüssigkeit und zieht sie anschließend wieder heraus, bleibt ein Rest Flüssigkeit in ihr stehen. Auch darin zeigt sich, dass die Grenzflächenspannung (die Adhäsionskräfte) stärker sein können als die Gravitation. Je dünner das Röhrchen, desto höher ist die hängen bleibende Flüssigkeitssäule.
- Abb. 10 ¦ Flüssigkeitssäule
-
Ein Strohhalm und das Röhrchen eines Wattestäbchens habe ich in rot gefärbtes Wasser gehalten und wieder herausgezogen.
Strohhalm: Durchmesser: ca. 4 mm, Wassersäule: ca. 2 mm
Wattestäbchen: Durchmesser: ca. 1,5 mm, Wassersäule: ca. 1,5 cm
© Wiebke Salzmann, Januar 2014
