Dr. Wiebke Salzmann
freie Lektorin und Autorin
Wissenstexte
Physik-Wissen
Energieniveaus
Auf dieser Seite erwartet Sie Wissenswertes zu Leitern, Halbleitern, Supraleitern.
www.wissenstexte.de > Physik-Wissen > Aufbau der Materie > Energieniveaus
Energieniveaus, Bänder und Energielücken
– Elektronen in Festkörpern – Bändermodell
– Elektronen in Supraleitern
Elektronen in Atomen und Molekülen
Freie Elektronen können jede beliebige Geschwindigkeit annehmen – mit anderen Worten: sie können jede beliebige Energie haben. (Von Beschränkungen durch die spezielle Relativitätstheorie, die ja bekanntlich Geschwindigkeiten verbietet, die über der Lichtgeschwindigkeit liegen, sehen wir jetzt mal ab.) Anders sieht es aus, wenn ein Elektron sich in einem Atom befindet – hier ist es gezwungen, ganz bestimmte Energiezustände oder Energieniveaus einzunehmen. Man stellt sich das bildlich oft so vor, als würde das Elektron sich auf bestimmten Bahnen bewegen. Dieses Bild ist jedoch sehr stark vereinfacht, da Elektronen Quantenobjekte sind und sich als solche nicht auf klar definierten Bahnen bewegen. Der Aufenthaltsort eines Elektrons ist nicht durch eine solche Bahn gegeben, sondern durch eine räumliche Wahrscheinlichkeitsverteilung – als Orbital bezeichnet. (Und nicht alle Orbitale haben Kugelform.) Jedes Orbital stellt ein Energieniveau dar. Soll ein Elektron von einem Energieniveau in ein anderes übergehen, muss es die fehlende Energie absorbieren oder die überschüssige abgeben. Da die Elektronen nur die festgelegten Energieniveaus einnehmen können, also auch nur zwischen diesen wechseln können, können sie auch nur ganz bestimmte Energien aufnehmen oder abgeben – nämlich diejenigen, die dem Unterschied zweier Energieniveaus entsprechen. (Es sei denn, es wird ihnen so viel Energie zugefürt, dass sie dem Atom vollständig entkommen können – die so genannte Ionisierungsenergie. Energien oberhalb der Ionisierungsenergie dürfen jeden beliebigen Wert haben.) Die Energie, um in ein höheres Niveau zu springen, kann durch elektromagnetische Strahlung, aber auch durch Stöße mit freien Elektronen übertragen werden. Eine Anregung über Stöße kommt beispielsweise beim Blitz vor (Wetter) oder bei dem Blitz zwischen den Elektroden der Wimshurst-Maschine (Wimshurst-Maschine).
Es können nicht zwei Elektronen denselben Energiezustand einnehmen.
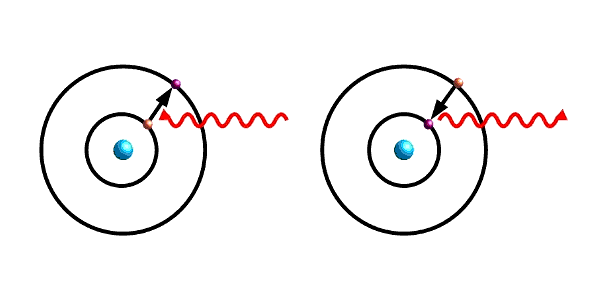
- Abb. 1 ¦ Elektron im Atom
-
Links: Absorbiert ein Elektron eine elektromagnetische Welle (Wellenlinie) mit passender Energie, kann es in ein energetisch höheres Orbital springen. (Für eine anschauliche Darstellung habe ich das stark vereinfachte Bild der Elektronenbahnen um den Atomkern genommen.)
Rechts: Fällt das Elektron wieder ein energetisch niedrigeres Orbital zurück, sendet es eine elektromagnetische Welle derselben Frequenz aus.
Verbinden sich nun zwei Atome zu einem Molekül, verschmelzen die beiden äußeren Orbitale der beiden Atome zu zwei Molekülorbitalen. Diese erstrecken sich über das ganze Molekül und bilden so die chemische Bindung zwischen den beiden Atomen. Auch zu jedem Molekülorbital gehört wieder ein bestimmter Energiewert, die beide in der Nähe der Energie der alten Orbitale der einzelnen Atome liegen. Schließen sich drei Atome zusammen, bilden sich aus den beteiligten Atomorbitalen drei Molekülorbitale – deren Energien ebenfalls in der Nähe der Energie des Atomorbitals liegen.
Elektronen in Festkörpern – Bändermodell
Schließen sich nun sehr viele Atome zusammen, wie dies in einem Festkörper der Fall ist, bilden sich entsprechend viele Molekülorbitale. Jedes Molekülorbital hat wiederum seinen ganz bestimmten Energiewert. Da diese Energiewerte aber alle innerhalb eines begrenzten Bereiches um die Energie des ursprünglichen Atomorbitals liegen, sind ihre Abstände sehr klein – so klein, dass die Energiewerte praktisch kontinuierlich sind. Das bedeutet, dass die einzelnen Molekülorbitale zu einem Energieband verschmieren.
Der Ausdruck „Band“ für die über den ganzen Kristall ausgedehnten Energiezustände hat daher nichts mit der räumlichen Form zu tun, sondern bezieht sich auf die (fast) kontinuierlichen Energiewerte – es handelt sich nicht etwa um ein „Band“, das sich durch den Kristall schlängelt. Das Energieband hüllt gewissermaßen alle Atome ein.
Zwischen den Bändern können aber weiterhin Energielücken liegen, die nicht besetzt werden können.
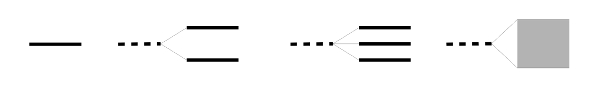
- Abb. 2 ¦ Vom Atomorbital zum Molekülorbital
-
Von links nach rechts (schematisch):
– Energie eines Atomorbitals
– die Energien der beiden Molekülorbitale bei einem zweiatomigen Molekül (gestrichelt: ursprüngliches Atomorbital)
– die Energien der drei Molekülorbitale bei einem dreiatomigen Molekül
– Energieband in einem Festkörper
Weil die Abstände zwischen den einzelnen Energieniveaus innerhalb eines Bandes also sehr klein sind, können die Elektronen leicht von einem Niveau ins nächste hüpfen. Aber auch im Band dürfen nicht zwei Elektronen exakt dieselbe Energie haben. Sind also alle Energiezustände in einem Band besetzt, können die Elektronen „ihren“ Zustand nicht verlassen – es sei denn, sie verlassen das Band und springen in ein anderes Band. Ob das möglich ist, hängt davon ab, wie groß der Energieunterschied zum nächsthöheren Band ist. Da die Energiebänder im Kristall an die Stelle der Orbitale im Atom treten, sind sie durch so genannte Energielücken voneinander getrennt – vergleichbar den energetischen Abständen zwischen den Orbitalen im Atom. In diesen Energielücken befinden sich keine Energieniveaus – so wie sich auch zwischen den Orbitalen in den Atomen keine möglichen Energieniveaus für Elektronen befinden.
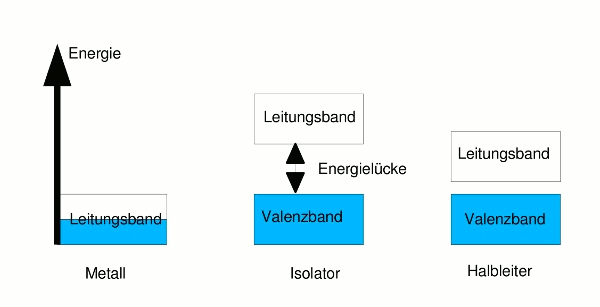
Die Größe der Energielücke und die Besetzung der Bänder ist nun das, was Metalle, Isolatoren und Halbleiter voneinander unterscheidet. Bei Metallen ist das (energetisch betrachtet) höchste Band, das noch Elektronen enthält, nicht vollständig gefüllt – die Elektronen finden innerhalb dieses Bandes also noch freie Energieniveaus und können sich im Band bewegen und einen Strom transportieren.
Das oberste mit Elektronen besetzte Band heißt Valenzband, dasjenige, in dem Leitung möglich ist, weil noch freie Plätze vorhanden sind, heißt Leitungsband. Bei Metallen ist das oberste Band daher zugleich Valenz- und Leitungsband. Man spricht i.A. vom Leitungsband.
Den Energiezustand ändern heißt die Geschwindigkeit ändern. Wird also eine elektrische Spannung an ein Metall angelegt, kann diese den Elektronen Energie zuführen, indem sie sie in ein höheres Energieniveau anhebt – oder klassisch ausgedrückt: indem sie sie in Bewegung setzt.
Bei Isolatoren (wie Diamant) ist das höchste Elektronen enthaltende Band vollständig gefüllt – die Elektronen finden keine freien Energieniveaus im Band und sind deshalb unbeweglich. (Dieses Band heißt Valenzband.) Um sie in Bewegung zu setzen, müssten sie so viel Energie erhalten, dass sie das nächsthöhere leere Band erreichen. (Dies ist das Leitungsband.) Die Energielücke zwischen dem Valenz- und dem Leitungsband ist aber zu groß, auch die Zufuhr von elektrischer Energie aus einer Spannungsquelle reicht nicht aus, um die Elektronen ins Leitungsband zu heben. Es kann daher kein Strom fließen.
Bei Halbleitern (wie Silicium) ist das Valenzband ebenfalls vollständig gefüllt, jedoch ist bei ihnen die Energielücke zum Leitungsband so klein, dass es leicht möglich ist, den Elektronen im Valenzband die Energie zuzuführen, die sie ins Leitungsband hebt. Schon bei Zimmertemperatur gelangen einige Elektronen vom Valenz- ins Leitungsband.
- Abb. 3 ¦ Energielücken

- Im Metall ist das Leitungsband zum Teil mit Elektronen besetzt (dargestellt durch die blaue Farbe), diese können die Energieniveaus innerhalb des Bandes leicht wechseln. In Isolator und Halbleiter ist das Leitungsband leer, das Valenzband ist voll besetzt. Weder in dem einen noch in dem anderen können sich daher Elektronen bewegen. Im Halbleiter können Elektronen aber leicht über die schmale Energielücke ins Leitungsband gehoben werden.
Elektronen in Supraleitern
In einem normalleitenden Metall liegen die Energiezustände der Elektronen also so dicht zusammen, dass sie als kontinuierlich angesehen werden können. Im elektrischen Leiter ist das oberste Energieband nicht vollständig besetzt, oberhalb einer bestimmten Energie (genannt Fermi-Energie) sind alle Zustände noch frei. In diese freien Zustände können die Elektronen bereits mit sehr wenig Energie springen und sich problemlos bei Anlegen einer Spannung als elektrischer Strom durch das Material bewegen. Daher dient das Valenzband hier gleichzeitig als Leitungsband (als was man dieses Band dann auch i. d. R. bezeichnet), beide sind zu einem Band verschmolzen.
Was geschieht nun bei Supraleitung? Ein normaler elektrischer Leiter hat einen elektrischen Widerstand. Das bedeutet, der elektrische Strom verliert Energie, welche ihm ständig durch die elektrische Spannung zugeführt werden muss. Der Widerstand kommt durch Fehlstellen im Gitterbau und die Wärmebewegung der Atome zustande. Die Wärmebewegungen bestehen im Festkörper aus Schwingungen der Atome um ihre Gitterplätze, mit diesen Gitterschwingungen (Phononen genannt) „stoßen“ die Elektronen zusammen. Damit wird der Widerstand in Metallen mit der Temperatur immer größer, weil die Wärmebewegung zunimmt. (Im Halbleiter ist dies etwas anders, da es hier noch den zweiten Effekt gibt, dass sich mit der Temperatur die Anzahl Elektronen erhöht, denen es gelingt, ins Leitungsband zu springen. Dadurch erhöht sich die Anzahl verfügbarer Ladungsträger und die Stromstärke steigt mit der Temperatur.) Das kommt zustande, weil ein Kennzeichen von Metallen ist, dass sie ihr äußerstes (manche auch die beiden äußersten) Elektronen leicht abgeben. Diese „schwimmen“ quasi-frei zwischen den Atomrümpfen (man spricht vom „Elektronensee“) und sind daher leicht beweglich.
Umgekehrt nimmt die Wärmebewegung mit fallender Temperatur ab. Bei manchen Materialien führt das dazu, dass unterhalb einer bestimmten Temperatur, der Sprungtemperatur, die Wärmebewegung so gering ist, dass die Phononen die Elektronen nicht mehr behindern. Im Gegenteil kann jetzt der Einfluss der Elektronen auf die Atome überhand nehmen – diese sind ja elektrisch negativ geladen, während die Atomrümpfe wegen des fehlenden Elektrons eine positive Ladung tragen. Dadurch zieht ein Elektron die Atomrümpfe an. Bei starker Wärmebewegung spielt dieser Effekt keine Rolle, weil die Ausrichtung der Atome gleich wieder zerstört wird. Stehen die Atome jedoch annähernd still, macht sich die Anziehung durch das Elektron bemerkbar und kann sich als Welle durch den Festkörper ausbreiten. Es ist also das Elektron, was hier eine Schwingung, ein Phonon, verursacht. Die nun ausgerichteten (polarisierten) Atome können ihrerseits ein weiteres Elektron anziehen. Damit vermitteln sie letztlich die Anziehung durch das erste Elektron – eine Bindung zwischen den beiden Elektronen ist entstanden. Dieses Elektronenpaar nennt man Cooper-Paar.
Was dies zur Folge hat, ist anschaulich nicht mehr zu verstehen. Ein Elektron hat einen halbzahligen Spin (den Spin kann man sich als Drehung um sich selbst vorstellen, er ist ein Drehimpuls). Ein Paar aus zwei Elektronen hat demzufolge einen ganzzahligen Spin (auch null zählt als ganzzahlig). Teilchen mit halbzahligem Spin nennt man Fermionen, solche mit ganzzahligem Spin heißen Bosonen. Beide Sorten haben unterschiedliches Verhalten: Fermionen dürfen in keiner ihrer Eigenschaften übereinstimmen. Eine Folge davon ist bspw. dass in jedem Energiezustand nur ein Elektron sitzen kann. Bosonen dagegen unterliegen dieser Einschränkung nicht, sie dürfen zu beliebig vielen in einen Energiezustand. Da alle Teilchen und Körper immer den niedrigst möglichen Energiezustand annehmen (Bälle rollen immer nach unten), versammeln sich also alle Bosonen im Zustand mit der niedrigsten Energie. (Fermionen müssen gezwungenermaßen auch in höhere, wenn die unteren schon besetzt sind.)
Da die Cooper-Paare nun also den Spin 0 (selten auch 1) haben und Bosonen sind, versammeln sie sich alle im niedrigsten Energiezustand. Wo also vorher das Energieband bis zur Fermi-Energie besetzt war, ist jetzt nur noch der niedrigste Zustand besetzt. Dadurch tut sich eine Energielücke um die Fermi-Energie auf, das Energieband spaltet sich auf.
Um die Cooper-Paare zu zerstören, muss nun eine Energie zugeführt werden, die mindestens die Höhe dieser Energielücke hat. Dazu reicht die Energie der Wärmebewegung der Atome nicht mehr aus. Diese thermischen Gitterschwingungen haben also keinen Einfluss mehr auf die Elektronen, sie behindern den Stromfluss nicht mehr. Der elektrische Widerstand ist null, der Festkörper ist supraleitend.
Aufheben kann man die Supraleitung durch Erhöhung der Temperatur, also dadurch, dass die Wärmebewegung der Atome verstärkt wird, oder auch durch Anlegen eines Magnetfeldes.
Bei den sogenannten Hochtemperatur-Supraleitung sind die Verhältnisse noch ungeklärt – inzwischen geht man davon aus, dass auch hier Cooper-Paare gebildet werden, aber auf welche Weise hier die Bindung zwischen den Elektronen übermittelt wird, ist weiterhin unklar.
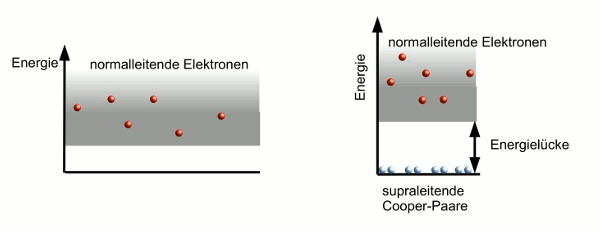
- Abb. 4 ¦ Energiezustände im Normal- und Supraleiter
-
Links: Im normalleitenden Metall liegen die Energiezustände so dicht, dass es für jede stoßbedingte Energieänderung einen passenden Energiezustand gibt.
Rechts: Im supraleitenden Material befinden sich alle Cooper-Paare im tiefsten Energiezustand und sind durch eine Energielücke von den Energiezuständen der normmalleitenden Elektronen getrennt.
Großansicht der Abbildung
© Wiebke Salzmann, April 2009
