Dr. Wiebke Salzmann
freie Lektorin und Autorin
Wissenstexte
Physik-Wissen
Fluoreszenz
Auf dieser Seite wird grün zu rot.
www.wissenstexte.de > Physik-Wissen > Optik > Licht im Medium > Fluoreszenz
Fluoreszenz
– Absorption und Fluoreszenz
– Fluoreszenz in Salatölen
– Fluoreszenz in Chlorophyll und Kastanien„saft“
– Fluoreszenz in Tonic Water bzw. in Chinin
Absorption und Emission
Licht ist eine elektromagnetische Welle. Je nach Frequenz hat eine elektromagnetische Welle eine bestimmte Energie. Trifft Licht auf ein Atom, kann diese Energie ein Elektron im Atom anregen – das bedeutet, die Energie der elektromagnetischen Welle geht auf das Elektron über und die Welle wird absorbiert. Das Elektron hat nun mehr Energie als vorher, es befindet sich in einem energetisch höheren Zustand oder Niveau. Stark vereinfacht kann man das so darstellen, dass ein Elektron von seiner ursprünglichen Elektronenbahn auf eine höhere springt. „Höher“ wird in der Regel als „weiter vom Atomkern entfernt“ dargestellt; es geht aber eigentlich um die höhere Energie, die das neue Niveau des Elektrons hat.
Die Energieniveaus haben in Atomen und Molekülen ganz bestimmte energetische Abstände. Die Wellen, die ein Atom absorbieren kann, müssen von ihrer Energie her genau zu diesen Abständen passen: Eine Welle kann nur dann absorbiert werden, wenn es zwei Energieniveaus im Atom gibt, deren energetischer Abstand genau der Wellenenergie entspricht. (Für ein einzelnes Atom gilt natürlich auch, dass im Ausgangsniveau ein Elektron sein muss und das Zielniveau frei sein muss. Hat man eine größere Menge des Stoffes wird die Bedingung für hinreichend viele Atome erfüllt sein.) Jedes Material kann also nur bestimmte Wellenlängen absorbieren.
Auf die Weise bekommt ein Körper seine Farbe, indem beispielsweise blau absorbiert wird und die übrigen reflektierten Wellenlängen die Komplementärfarbe Orange ergeben – der Körper erscheint uns orangefarben. (Farbe ist keine physikalische Eigenschaft, sondern eine menschliche Wahrnehmung der elektromagnetischen Wellen, die uns von einem Körper erreichen.)
Neben der Absorption von elektromagnetischen Wellen gibt es auch andere Möglichkeiten der Anregung: beispielsweise, indem durch Stöße zwischen Atomen Elektronen auf höhere Niveaus gelangen, das wiederum kann man durch Erhitzen eines Körpers oder durch eine elektrische Spannung erreichen, die Elektronen oder Ionen in Bewegung setzt.
Angeregte Zustände sind unterschiedlich stabil.
Die so angeregten Elektronen können wieder in ein niedrigeres Niveau zurückfallen und dabei ihrerseits elektromagnetische Wellen aussenden oder emittieren. Auch hierbei gilt, dass nur Licht solcher Energien oder Frequenzen emittiert werden kann, zu dem im Atom Niveaus mit dem passenden Energieunterschied existieren.
Bei der Emission von elektromagnetischen Wellen springt das Elektron vom höheren Niveau in ein tieferes. Das Elektron hat also anschließend weniger Energie, ihm fehlt genau die Energie, die mit der Welle ausgesandt wurde.
In Leuchtstoffröhren werden die Atome beispielweise durch Stöße angeregt. Das Licht, das sie aussenden, wenn sie wieder in niedrigere Zustände zurückfallen, erzeugt das Lampenlicht.
Wenn ein Körper (ausreichend) Licht im Sichtbaren emittiert, nehmen wir ihn als selbstleuchtend wahr.
- Abb. 1 ¦ Elektron im Atom
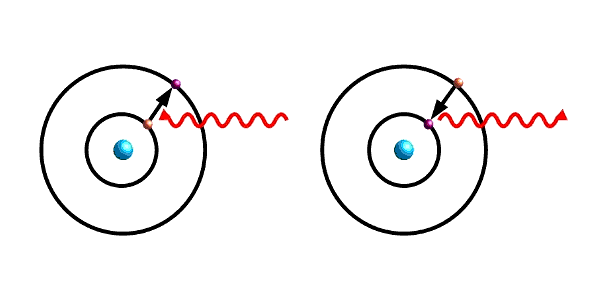
-
Links: Absorbiert ein Elektron eine elektromagnetische Welle (rote Wellenlinie) mit passender Energie, kann es auf ein energetisch höheres Niveau springen. (Für eine anschauliche Darstellung habe ich das stark vereinfachte Bild der Elektronenbahnen um den Atomkern genommen.)
Rechts: Fällt ein angeregtes Elektron in ein energetisch niedrigeres Niveau zurück, sendet es eine elektromagnetische Welle derjenigen Frequenz aus, die dem energetischen Unterschied zwischen den beiden Niveaus entspricht.
Fluoreszenz
Fluoreszenz tritt auf, wenn ein der angeregte Zustand eines Atoms nicht stabil ist und das Elektron rasch wieder in das niedrigere Niveau zurückfällt. Dabei gibt es einen Teil der Energie aber nicht als Licht ab, sondern in Form von Schwingungsenergie, also Wärme (Wärme ist nichts anderes als Bewegung von Teilchen). Die restliche Energie wird als elektromagnetische Welle emittiert. Das führt dazu, dass das emittierte Licht eine größere Wellenlänge (also eine geringere Energie) hat, als das zur Anregung ursprünglich absorbierte Licht.
Dieses emittierte Licht nennt man Fluoreszenzlicht.
Fluoreszenz findet gegenüber der Anregung mit einer zeitlichen Verzögerung statt, die aber so klein ist, dass sie nicht wahrnehmbar ist. Findet die Fluoreszenz mit größerer zeitlicher Verzögerung statt, leuchtet das Material nach und man spricht von Phosphoreszenz.
- Abb. 2 ¦ Fluoreszenz
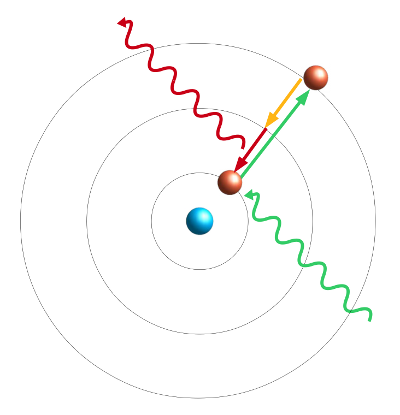
- Eine elektromagnetische Welle regt ein Elektron auf ein höheres Energieniveau an (grün) und wird dabei absorbiert. Das Elektron springt spontan zurück auf das ursprüngliche Energieniveau, tut dies aber in zwei Stufen. Einen Teil der Energie gibt es dabei als Wärme ab (gelb) und nur den Rest als elektromagnetische Welle (rot). Diese hat daher eine niedrigere Energie (größere Wellenlänge) als die ursprünglich absorbierte, grün dargestellte Welle.
Fluoreszenz in Salatöl
Auf die Idee zu den folgenden Versuchen brachte mich ein Besucher meiner Internetseite, der mit dem Problem auf mich zukam, wieso ein grüner Lichtstrahl in Pflanzenöl plötzlich rot leuchtet. Da ich mir das zunächst auch nicht erklären konnte, war meine Neugier geweckt.
Ich habe Salatöle mit dem Licht einer weißen Taschenlampe, eines roten und eines grünen Laserpointers durchleuchtet.
Was würde man ohne Fluoreszenz erwarten? Dazu erst einmal Untersuchungen an Saft: Bestimmte Wellenlängen werden absorbiert, die übrigen werden durchgelassen und (im sichtbaren Bereich) als Farbe der Flüssigkeit wahrgenommen. Bei weißem Licht gelangen nur die nicht absorbierten Wellenlängen auf die andere Seite der Flüssigkeit. Verwendet man farbiges Licht einer einzigen Wellenlänge (solches Licht heißt monochromatisch), gelangt es nur dann auf die andere Seite, wenn es eine nicht-absorbierte Wellenlänge hat. Der Strahl, der in der Flüssigkeit zu sehen ist, verhält sich genauso – entspricht seine Wellenlänge einer nicht-absorbierten, ist der Strahl in der Flüssigkeit zu sehen, hat er eine Wellenlänge aus dem absorbierten Bereich, verschwindet er rasch hinter der Eintrittsstelle oder ist gar nicht zu sehen, je nach dem wie stark die Absorption ist.
(Dass der Strahl überhaupt von der Seite zu sehen ist, liegt an der Streuung des Lichtes an Schwebstoffen oder emulgierten Partikeln in der Flüssigkeit. Sind nur wenige solcher streuenden Teilchen vorhanden, sieht man den Strahl auch nicht).
- Abb. 3a ¦ Rhabarbersaft
- Links: Weißes Licht durch Rhabarbersaft. Blaue Anteile werden absorbiert, grün, rot und und gelb werden durchgelassen, sodass das austretende Licht orange gefärbt ist (der Komplementärfarbe zu Blau). Der Lichtstrahl im Saft ist ebenfalls orangefarben wie der der Saft.
Mitte: Grünes Licht durch Rhabarbersaft. Offenbar wird Grün nicht besonders stark absorbiert, man sieht den grünen Strahl durch den Saft gehen und links wieder austreten (siehe den grünen Punkt am Boden).
Rechts: Rotes Licht durch Rhabarbersaft. Rot wird ebenfalls kaum absorbiert, man sieht den roten Strahl durch den Saft gehen und links wieder austreten.
- Abb. 3b ¦ Saft aus roten Johannisbeeren
- Links: Rotes Licht durch Johannisbeersaft. Der Saft lässt nur rotes Licht durch, weshalb er rot erscheint, andere Wellenlängen werden absorbiert.
Rechts: Grünes Licht durch Johannisbeersaft. Grünes Licht wird absorbiert, weder sieht man einen Strahl im Saft, noch einen Austrittspunkt am Boden hinter dem Glas (der wäre rechts neben dem Glas zu erwarten).
Und nun die Versuche noch einmal mit Salatölen, wieder mit weißem, grünem und rotem Licht. Einige Salatöle zeigen Fluoreszenzerscheinungen, am deutlichsten sieht man es bei Olivenöl (von den Ölen, die ich ausprobiert habe).
Grünes Licht gelangt zwar durch das Öl hindurch, etwas davon wird aber absorbiert und regt die Moleküle im Öl zu rötlicher Fluoreszenz an – das rote Fluoreszenzlicht ist also energieärmer als das anregende grüne Licht.
Man sieht den grünen Strahl rechts auch wieder grün austreten. Etwas anderes als grünes Licht kann aus dem Öl nicht austreten, da der Laser monochromatisches Licht aussendet. Es gelangt also nur grünes Licht in das Öl hinein und kann auch nur grünes Licht wieder herauskommen. Würde es absorbiert, käme gar nichts hinten an, es kann aber keine andere Farbe entstehen.
Der Strahl im Öl leuchtet aber dennoch in einer anderen Farbe, nämlich gelb-rötlich, bei Olivenöl sogar richtig rot. Diese Farbänderung im Öl entsteht durch Fluoreszenz, das grüne Licht regt rötliches Fluoreszenzlicht an. Das Fluoreszenzlicht wird in alle Raumrichtungen abgestrahlt und überwiegt das Streulicht, das von dem grünen Laserstrahl ausgeht. Deshalb ist der Strahl im Öl rötlich wahrzunehmen. Es hat also nicht der grüne Strahl im Öl seine Farbe geändert, sondern er ist gegen das von ihm erzeugte Fluoreszenz nicht mehr mit bloßem Auge zu erkennen. Dass der grüne Strahl aber noch „da ist“, sieht man an den grünen Reflexionen an Luftblasen.
Noch dunkler ist das Fluoreszenz-Rot bei Kürbiskernöl, dieses absorbiert aber auch das rote Licht stärker, sodass der fluoreszierende Strahl bereits kurz hinter der Glaswand nicht mehr zu sehen ist.
- Abb. 4a ¦ Olivenöl
- Links: Weißes Licht durch OLivenöl. Es tritt rechts mit der grünlich-gelben Farbe aus, die Olivenöl hat, da blaue Anteile absorbiert werden, sodass ein grünliches Gelb übrig bleibt. Der Strahl im Öl leuchtet dagegen aufgrund der Fluoreszenz rötlich (rötlicher, als hier auf dem Foto zu sehen).
Mitte: Rotes Licht durch Olivenöl. Rotes Licht wird nicht absorbiert, sondern durchgelassen und kommt rechts wieder heraus aus dem Öl; auch der Strahl im Öl erscheint rot. Wobei man mit bloßem Auge nicht sagen kann, ob man im Strahl das rote Laserlicht oder auch fluoreszierende Anteile sieht – dafür reicht das Handspektroskop nicht aus.
Rechts: Grünes Licht durch Olivenöl. Am grünen Punkt auf dem Boden sieht man, dass grünes Licht das Öl auch wieder verlässt. Es wird also nicht oder nur wenig absorbiert. Der Strahl im Öl dagegen erscheint rot. (Die grünen Punkte sind Reflexionen an Luftblasen.) Das grüne Laserlicht regt die Moleküle also zum Fluoreszieren im Roten an.
- Abb. 4b ¦ Olivenöl II
- Ich habe hier das Glas mit dem Olivenöl in ein größeres Glas gestellt. In dem größeren Glas befand sich Wasser mit ganz wenig Quarkwasser. (Milch wäre auch gegangen, es kommt nur darauf an, dass sich anschließend im Wasser streuende Teilchen befinden, weil der Lichtstrahl sonst von der Seite nicht sichtbar ist.) Der grüne Laserstrahl läuft von links durch beide Gläser – im Öl sieht man das rote Fluoreszenzlicht, im Quarkwasser das originale grüne Licht des Lasers.
Da ich noch eine Festplatte mit einer blauen Kontrollleuchte habe, habe ich auch noch untersucht, was mit blauem Licht im Olivenöl passiert. Blau wird von Olivenöl absorbiert. Es regte zunächst ebenfalls rote Fluoreszenz an, allerdings war die Fluoreszenz nur über eine kurze Strecke zu sehen, danach war schon zu viel blaues Licht absorbiert.
Die blaue LED sendet jedoch kein rein blaues Licht aus, es enthält Anteile von Violett und Grün. Das grüne Licht wird durchgelassen (erkennbar an einem schwachen grünen Fleck an der Wand). Das durch das Öl gehende grüne Licht war aber nicht intensiv genug, um eine erkennbare Fluoreszenz zu erzeugen – zumal das Licht der LED-Leuchte nicht so stark gebündelt ist wie der Laserstrahl des Pointers.
- Abb. 4c ¦ Olivenöl III
- Links: Blaues Licht durch OLivenöl. Es wird rasch so weit absorbiert, dass es nicht mehr zu erkennen ist – erzeugt über die kurze Strecke aber die zu erwartende rötliche Fluoreszenz (der rote Punkt am rechten Glasrand; die roten Flecke rechts oben sind Spiegelungen am Glas).
Rechts: Da das Licht der LED nicht rein blau war, sondern auch violette und grüne Anteile enthielt und Grün vom Olivenöl durchgelassen wird, entstand hinter dem Öl ein grüner Fleck an der Wand.
Verschiedene Ölsorten erzeugen unterschiedlich starke Rotfärbungen des fluoreszierenden Strahls. Distelöl und Walnussöl zeigten keine sichtbare Fluoreszenz, hier blieb der grüne Strahl auch im Öl grün. Lein- und Rapsöl erzeugten ein gelblich-rotes Fluoreszenzlicht.
- Abb. 4c ¦ Grünes Laserlicht in verschiedenen Ölen
- Links: Distelöl
Mitte: Leinöl
Rechts: Rapsöl
Was da genau im Salatöl fluoresziert, ist das Chlorophyll, daher vermute ich, dass die unterschiedlich starke Fluoreszenz durch unterschiedliche Chlorophyll-Gehalte im jeweiligen Öl hervorgerufen wird.
Fluoreszenz in Chlorophyll und Kastanien„saft“
Chlorophyll
Die Fluoreszenz von Chlorophyll lässt sich beobachten, wenn man eine Chlorophyll-Lösung mit UV-Licht bestrahlt.
Chorophyll absorbiert in den Wellenlängenbereichen um 400–430 nm (blau) und um 640–680 nm (rot). Logischerweise müsste es dann auch in diesen Wellenlängenbereichen emittieren – nach Anregung durch UV-Licht wird jedoch ein Teil der absorbierten Energie als Wärme (Schwingungsenergie) abgegegeben, weshalb nur das rote Licht als Fluoreszenzlicht abgegeben wird (das Maximum liegt bei etwa 670 nm).
Um die Fluoreszenz von Chlorophyll zu beobachten, muss man zunächst das Chlorophyll aus den Blättern extrahieren (solange es sich im Blatt befindet, wird UV-Licht im Wesentlichen für Photosynthese genutzt, die Fluoreszenz ist nicht zu sehen. Ich habe Löwenzahnblätter mit Seesand in Spiritus zerrieben (mit einem alten Löffel) und das Ganze noch über Nacht stehen lassen. Dann habe ich mit einer UV-Lampe, die zur Überprüfung von Geldscheinen gedacht ist, die Lösung beleuchtet. Die Lampe erzeugt Licht im blauen Bereich und im nahen UV. Die rote Fluoreszenz des Chlorophyll war nur im Dunkeln zu sehen.
- Abb. 5a ¦ Chlorophyll im weißen Licht
- Im weißen Licht einer gewöhnlichen LED-Taschenlampe leuchtet die Chlorophyll-Lösung wie erwartet grün.
- Abb. 5b ¦ Chlorophyll in UV-Licht
- Die verwendete Lampe erzeugt Licht im nahen UV und sichtbaren Blau. Die Chlorophyll-Lösung fluoresziert rot.
Kastanien
Stellt man einen Zweig einer Rosskastanie in warmes Wasser, sieht man im Tageslicht nur das – Kastanienzweige in klarem Wasser. Beleuchtet man das Ganze jedoch mit UV-Licht, sieht man blaue (mit einem leichten Stich ins türkise) Schlieren, die aus dem Zweig austreten und sich im Wasser ausbreiten. Diese fluoreszierenden Schlieren sind eine Substanz namens Aesculin, die aus den Zweiten austritt.
- Abb. 6 ¦ Fluoreszenz von Aesculin
- Stellt man Kastanienzweige in warmes Wasser, tritt aus den Schnittstellen ein Stoff namens Aesculin aus. Dieser fluoresziert blau, wenn man ihn mit UV-Licht bestrahlt. Deutlich sind die fluoreszierenden Schlieren zu erkennen, in denen das Aesculin aus den Zweigen austritt und sich im Wasser ausbreitet.
Tonic Water
Auch Tonic Water fluoresziert, wenn man es mit UV-Licht beleuchtet (im Versuch habe ich eine Lampe benutzt, die UV-Licht der Wellenlänge 365 nm aussendet). Der Stoff, der hier die Fluoreszenz verursacht, ist das Chinin, das dem Getränk auch die leicht bittere Note verleiht.
Mithilfe des Taschenspektroskop erkennt man, dass das Fluoreszenzlicht im Wellenlängenbereich von ca. 420 bis 520 nm zu erkennen ist (die Lichtintensität ist sehr schwach). Das erklärt, warum der grüne und der rote Laserpointer im Tonic Water keine Fluoreszenz mehr hervorrufen können.
- Abb. 7 ¦ Fluoreszenz von Chinin

- Das obere Bild zeigt ein Glas Wasser (links) und eins mit Tonic Water (rechts) im Tageslicht. Im unteren Bild sind beide Gläser im Licht einer UV-Lampe (365 nm) zu sehen. Im Tonic Water ist deutlich die hellblaue Fluoreszenz des enthaltenen Chinins zu sehen.
© Wiebke Salzmann, Dezember 2021
